FDA, 美마드리갈 NASH 치료제 품목허가 심사 수락
-
기사 스크랩
-
공유
-
댓글
-
클린뷰
-
프린트
1일 1회 먹는 THR-β 작용제
PDUFA 심사기일 내년 3월 14일
PDUFA 심사기일 내년 3월 14일
미국 마드리갈파마슈티컬스는 미국식품의약국(FDA)이 비알코올성 지방간염(NASH) 치료제 후보물질 ‘레스메티롬’의 품목허가(NDA) 심사를 수락했다고 13일(현지시간) 밝혔다.
이 소식에 마드리갈 주가는 전일 종가 대비 7.67% 상승했다.
레스메티롬은 1일 1회 먹는(경구용) 갑상선호르몬수용체베타(THR-β) 작용제다. THR-β는 지방을 분해하고 미토콘드리아 활성을 조절하는 등 간 기능을 유지하는 데 중요한 역할을 하는 것으로 알려졌다.
FDA는 간섬유증을 동반한 NASH 치료에 대해 레스메티롬을 심사할 예정이다. 우선 심사(priority Review) 지정을 부여하고 처방의약품신청자비용부담법(PDUFA)에 따른 심사 기일을 내년 3월 14일로 정했다. 우선 심사는 시판허가 신청 시 검토기간을 일반적인 10개월에서 6개월로 단축하는 제도다.
FDA는 자문위원회 회의를 열 계획이 없다고 마드리갈에 통보했다. FDA는 품목허가 여부를 판단하는 데 어려움을 겪거나 쟁점이 발생하는 경우, 외부 전문가로 구성된 자문위로부터 조언을 구한다. 심사 결과에 대한 해석이 나뉠 여지가 없다면 자문위 회의를 생략하기도 한다. 업계에 따르면 자문위 회의의 생략은 허가에 긍정적인 신호로 받아들여진다.
마드리갈은 레스메티롬의 NDA 신청을 위해 총 18개의 임상 연구(임상 1상 12건, 2상 2건, 3상 3건)를 수행했다.
빌 시볼드 마드리갈 대표는 “간 섬유증을 동반한 NASH는 환자에게 치료하지 않으면 간경화 간부전 간암의 위험 증가로 이어질 수 있다”며 “레스메티롬은 간 섬유증을 치료하는 동시에 질병을 유발하는 근본적인 지방간염을 해결할 수 있는 가능성을 입증한 치료법”이라고 했다.
NASH는 음주가 아닌 이유로 간에 지방이 쌓이고 염증이 진행되는 만성질환이다. 간경변이나 간암으로 악화될 수 있다. 현재까지 FDA 허가를 받은 NASH 치료제는 없다.
국내에서는 이 글루카곤, GLP-1, GIP 수용체를 동시에 활성화하는 삼중작용제 ‘에포시페그트루타이드’ 및 GLP-1 및 글루카곤수용체 이중작용제 ‘에피노페그튜타이드’의 글로벌 임상 2상을 각각 진행 중이다.
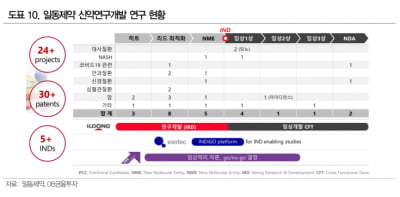
은 파네소이드X수용체(FXR)를 활성화하는 NASH 치료제를 개발 중이다. FXR이 활성화되면 간의 지질 및 당 대사, 담즙산 생성 및 배출, 염증 반응 등에 관여하는 것으로 알려졌다. 일동제약은 미국에서 건강한 성인을 대상으로 임상 1상을 진행하고 있다.
은 2019년 베링거인겔하임에 GLP-1과 FGF21 이중작용제 ‘YH25724’를 기술이전했다. 베링거인겔하임은 YH25724의 1상을 유럽에서 진행 중이다.
박인혁 기자 hyuk@hankyung.com
**이 기사는 2023년 9월 14일 08시 27분 <무료 슬롯 사이트 바이오인사이트 온라인에 게재됐습니다.
이 소식에 마드리갈 주가는 전일 종가 대비 7.67% 상승했다.
레스메티롬은 1일 1회 먹는(경구용) 갑상선호르몬수용체베타(THR-β) 작용제다. THR-β는 지방을 분해하고 미토콘드리아 활성을 조절하는 등 간 기능을 유지하는 데 중요한 역할을 하는 것으로 알려졌다.
FDA는 간섬유증을 동반한 NASH 치료에 대해 레스메티롬을 심사할 예정이다. 우선 심사(priority Review) 지정을 부여하고 처방의약품신청자비용부담법(PDUFA)에 따른 심사 기일을 내년 3월 14일로 정했다. 우선 심사는 시판허가 신청 시 검토기간을 일반적인 10개월에서 6개월로 단축하는 제도다.
FDA는 자문위원회 회의를 열 계획이 없다고 마드리갈에 통보했다. FDA는 품목허가 여부를 판단하는 데 어려움을 겪거나 쟁점이 발생하는 경우, 외부 전문가로 구성된 자문위로부터 조언을 구한다. 심사 결과에 대한 해석이 나뉠 여지가 없다면 자문위 회의를 생략하기도 한다. 업계에 따르면 자문위 회의의 생략은 허가에 긍정적인 신호로 받아들여진다.
마드리갈은 레스메티롬의 NDA 신청을 위해 총 18개의 임상 연구(임상 1상 12건, 2상 2건, 3상 3건)를 수행했다.
빌 시볼드 마드리갈 대표는 “간 섬유증을 동반한 NASH는 환자에게 치료하지 않으면 간경화 간부전 간암의 위험 증가로 이어질 수 있다”며 “레스메티롬은 간 섬유증을 치료하는 동시에 질병을 유발하는 근본적인 지방간염을 해결할 수 있는 가능성을 입증한 치료법”이라고 했다.
NASH는 음주가 아닌 이유로 간에 지방이 쌓이고 염증이 진행되는 만성질환이다. 간경변이나 간암으로 악화될 수 있다. 현재까지 FDA 허가를 받은 NASH 치료제는 없다.
국내에서는 이 글루카곤, GLP-1, GIP 수용체를 동시에 활성화하는 삼중작용제 ‘에포시페그트루타이드’ 및 GLP-1 및 글루카곤수용체 이중작용제 ‘에피노페그튜타이드’의 글로벌 임상 2상을 각각 진행 중이다.
은 파네소이드X수용체(FXR)를 활성화하는 NASH 치료제를 개발 중이다. FXR이 활성화되면 간의 지질 및 당 대사, 담즙산 생성 및 배출, 염증 반응 등에 관여하는 것으로 알려졌다. 일동제약은 미국에서 건강한 성인을 대상으로 임상 1상을 진행하고 있다.
은 2019년 베링거인겔하임에 GLP-1과 FGF21 이중작용제 ‘YH25724’를 기술이전했다. 베링거인겔하임은 YH25724의 1상을 유럽에서 진행 중이다.
박인혁 기자 hyuk@hankyung.com
**이 기사는 2023년 9월 14일 08시 27분 <무료 슬롯 사이트 바이오인사이트 온라인에 게재됐습니다.
ⓒ 무료 슬롯 사이트닷컴, 무단전재 및 재배포 금지



![K팝 업계에도 '친환경' 바람…폐기물 되는 앨범은 '골칫거리' [연계소문]](https://img.hankyung.com/photo/202206/99.27464274.3.jpg)


